
今日继续梳理国内UCAR-T的管线布局,并具体介绍目前披露信息较多的几家企业。
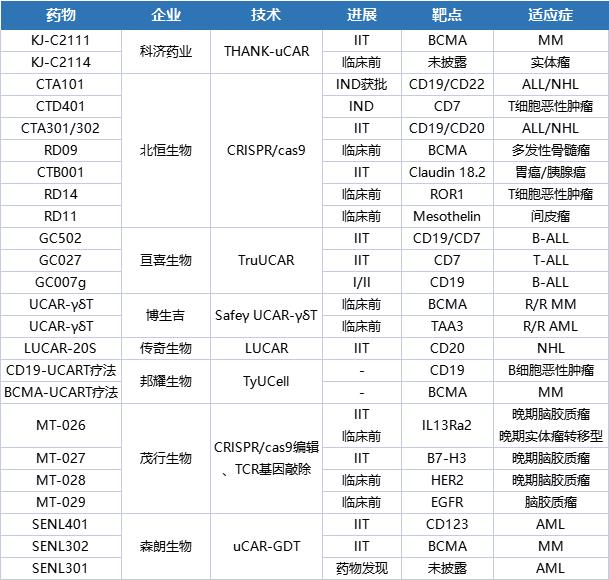
亘喜生物具有自主研发的FasTCAR(自体)和TruUCAR(同种异体)两大技术平台,以及SMART CARTTM技术模块。TruUCAR技术是亘喜同种异体CAR-T疗法的专有平台,其主要优势在于有望无需通过结合额外的免疫抑制疗法以消除宿主抗移植物排斥反应 (HvG);作为单用疗法,单次输注即有望消除肿瘤细胞;节省开支且便于使用;能缩短治疗时间,进一步扩大患者可及性。为降低同种异体T细胞引发的移植物抗宿主病(GvHD)风险,其利用CRISPR/Cas9破坏TRAC位点,以消除UCAR-T产品TCR复合物的表面表达。同时,利用CRISPR/Cas9破坏CD7以防止CAR-T细胞间互相杀伤。
亘喜还拥有一整套专有的基因工程改造技术,可与FasTCAR 和 TruUCAR 技术平台相结合,生产双特异CAR和增强型CAR。双特异CAR能有效减少基于TruUCAR技术开发的同种异体CAR-T细胞对患者造成的排斥反应。目前,亘喜生物UCAR-T产品包括GC027、GC502和GC007g。

GC007g是供者来源CAR技术,基于HLA匹配生产同种异体CAR-T细胞,为不太适合自体CAR-T细胞疗法的患者提供备选方案。供者来源CAR技术旨在从已与患者HLA匹配的健康供者身上获取更高质量的T细胞,用于生产肿瘤清除能力更强、缓解率和疗效持久性更高的CAR-T细胞 GC007g结构
GC007g结构
GC007g注射液是国内第一款进入临床阶段的UCAR-T疗法,已在国内完成IIT临床试验,相关数据如下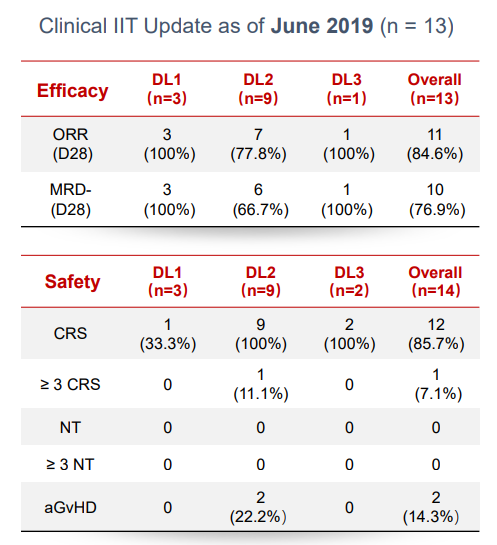
目前正在进行Ⅰ期临床试验,结果显示,在13名可评估受试者中,ORR达84.6%(13/14),MRD-CR达76.9%。
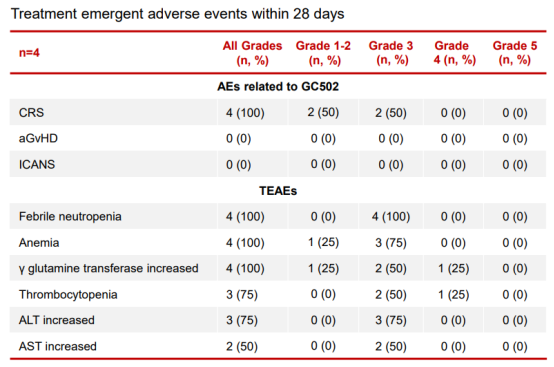
GC502是靶向CD19/CD7的双靶向UCAR-T产品,主要用于治疗B-ALL。临床前研究模型中GC502展现出卓越的抗肿瘤活性,以及对宿主抗移植物(HvG)排斥反应的抑制效果。目前GC502正在中国开展IIT临床试验,今年4月的AACR年会上首次公布了相关数据。疗效方面,4名患者中有3名患者达到了微小残留病灶阴性的完全缓解/血细胞数量未完全恢复的完全缓解(MRD-CR/CRi);1名患者在1个月时达到了部分缓解,随后在第39天接受了同种异体造血干细胞移植。安全性方面,患者在治疗中出现了2级/3级的细胞因子释放综合征(CRS),未出现4级/5级的CRS,同时,未观察到免疫效应细胞相关神经毒性综合征(ICANS)或急性移植物抗宿主病(aGvHD)。
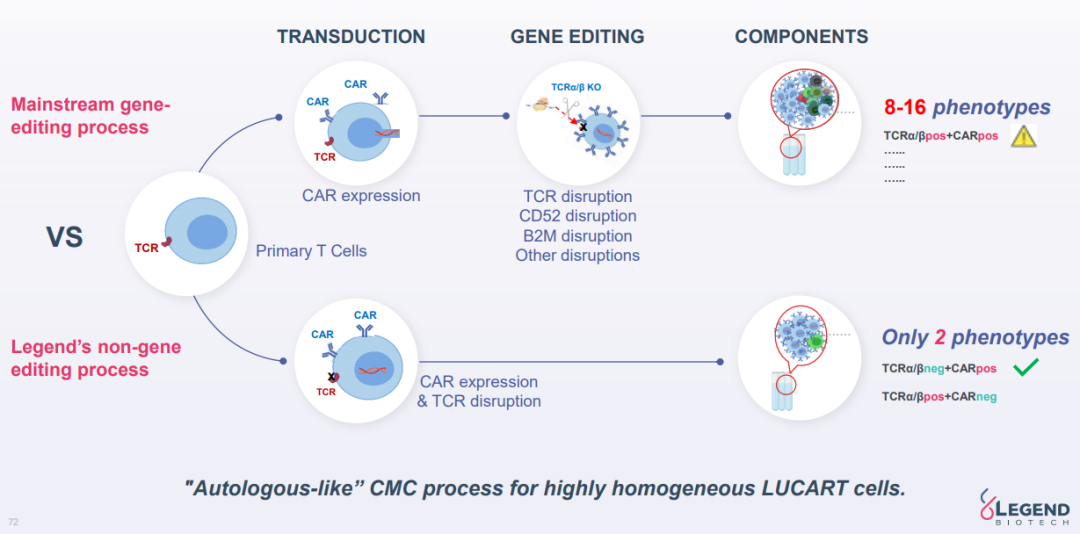
GC027是靶向CD7的UCAR-T产品,主要用于治疗T-ALL。临床前数据表明GC027具有优越的体外杀伤癌细胞的能力,同时在体内移植和抗白血病方面具有一定优势目前GC027正处于IIT期试验研究,在疗效方面,CR/CRi (6/6)为100%,MRD-CR/CRi (5/6)为83%,mPFS为7.75个月,最长的DOR(MRD-CR)为16.8个月。安全性方面6例患者均耐受,未观察到ICANS,无GvHD,6例患者有CRS,没有5级CRS发生。传奇生物所采用的的是其独有的LUCAR技术平台,该技术主要通过基因X的共表达破坏T细胞中内源性T细胞受体(TCR)复合物的活性,解决异体CAR-T免疫排斥反应。LUCAR技术采用非基因编辑平台,其优势在于它能避免多重基因编辑过程并且克服了脱靶效应和基因毒性遗传风险。
LUCAR-20SD是靶向CD20的UCAR-T产品,主要用于治疗复发或难治性CD20+非霍奇金淋巴瘤患者。目前,LUCAR-20SD正处于IIT临床试验,已有5例患者接受给药,3例(60%)获得部分缓解(PR),未观察到剂量限制性毒性(DLT)。
CTA010是北恒生物自主研发的靶向CD19/CD22的双靶向UCAR-T产品,用于治疗r/r B-ALL。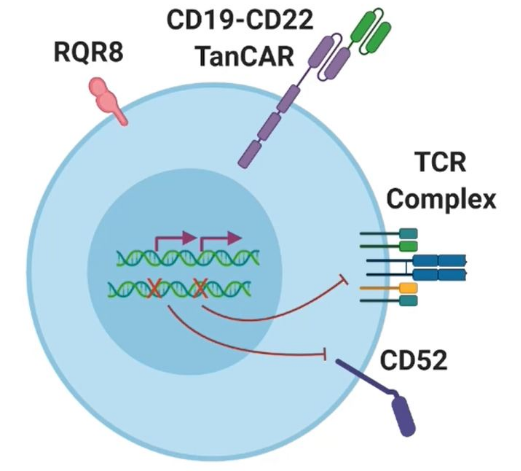
今年3月,CTA010已获得NMPA批准进入临床试验,此前IIT临床结果显示:5例受试者获得了MRD阴性的完全缓解 (CR),CR 率为 83.3%,2例受试者获得了长期缓解。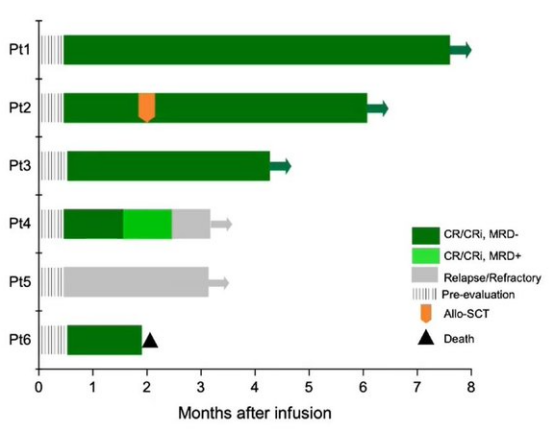
安全性特征良好,没有发生剂量限制性毒性(DLTs)、移植物抗宿主病(GvHD)、神经毒性及基因组编辑相关的不良事件。所有受试者均出现细胞因子释放综合征(CRS),以轻中度为主,仅1名受试者发生了3级CRS。博生吉主要采用的技术平台为Safeγ UCAR-γδT技术,该技术将γδT细胞改造成CAR-γδT细胞,能对靶点阳性的肿瘤展现出非常强的特异性杀伤。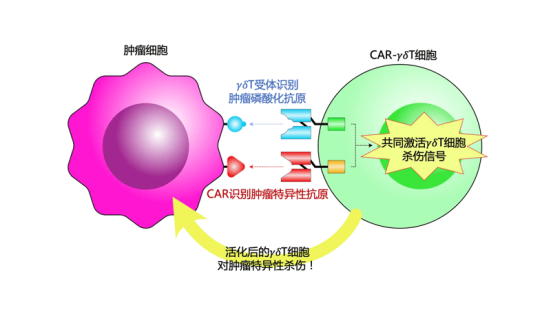
目前,公司已有多个针对不同靶点(实体瘤、BCMA等)的UCAR-γδT细胞产品在研。
科济生物主要的同种异体CAR-T平台是THANK-uCAR技术平台,该技术将识别NK细胞表面蛋白NKG2A的CAR装载到UCAR-T细胞中,阻止宿主NK细胞的攻击,可以防止宿主NK细胞的排异,THANK-uCAR-T细胞能更好的存活和增殖。
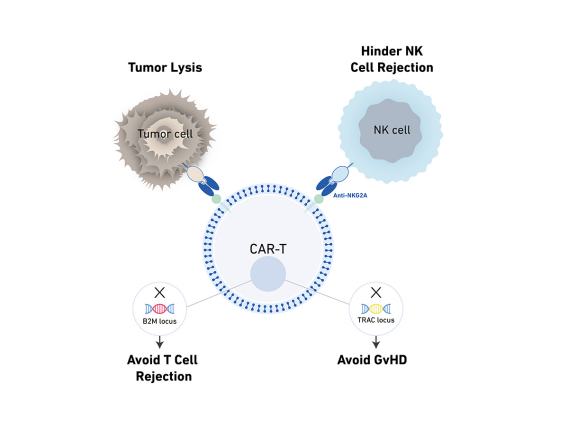
目前,科济生物的UCAR-T产品有两款,KJ-C2111是靶向BCMA的UCAR-T,用于治疗多发性骨髓瘤(MM),目前处于IIT实验阶段;KJ-C2114目前还在临床前研究阶段。
GC007g结构